- 세계적 과학 전문지 ELSEVIER을 중심으로 -
리튬이온 배터리의 에너지 저장 기술은 세상을 더 편안하고 윤택하게 만들었다. 우리 주변을 둘러보면 리튬이온 배터리를 적용한 제품들을 손쉽게 찾아볼 수 있다.
배터리로 연결되는 세상인 BOT(Battery of Things)라 불려도 이상하지 않을 정도다. 이동 수단인 전기차(Electric Vehicles)부터 ESS(Energy Storage System), 스마트폰까지 이젠 배터리 없이 살아갈 수 없는 세상에 대해 더 이상의 미사여구가 필요할까?
이런 리튬이온 배터리가 재난 분야에서 또 다른 주인공으로 떠오르는 데는 긴 시간이 걸리지 않았다. 전기차와 ESS 등에서 발생한 화재는 우리에게 당혹감과 함께 대응에 대한 어려움을 각인시켜 줬다.
이런 실정에 막연한 두려움과 걱정이 커져 과학적이고 공학적인 데이터 기반의 대응에 민첩하게 반응하지 못한 건 사실이다. 많은 시간이 흐르고 나서야 진압 대응책으로 ‘물’이란 무기를 확인시켰을 뿐이다.
지피지기면 백전백승이랄까? 리튬이온 배터리에 대한 보다 정확한 원리와 개념을 알면 그에 따른 문제가 보이고 이는 우리의 대응 방향에도 도움이 될 거로 생각한다.
다시 돌아와 리튬이온 배터리에 대한 여러 문제는 기존 연구와 개발 과정에서 대부분 밝혀졌다. 여러 문헌 등을 통해서도 잘 소개됐다. 즉 이런 문제점을 극복해 최종 개발된 게 현재 사용하는 리튬이온 배터리다. 극복 과정에서의 문제는 명확했다.
따라서 이런 부분을 초기에 집중해 분석했다면 더 좋지 않았을까? 이런 맥락에서 세계적 과학 전문지인 ELSEVIER사의 학술지 ‘Process Safety and Environmental Protection(IF: 7.962/Accept: 23 June 2011)’에 발표된 ‘A review of hazards associated with primary lithium and lithium-ion batteries(일차 리튬ㆍ리튬이온 배터리에 관한 위험성 검토)’의 내용을 중심으로 리튬이온 배터리의 위험성에 대해 알아보겠다.
Introduction
1990년대 이후 일차 리튬 배터리와 리튬이온 배터리는 다른 배터리 기술에 비해 에너지 밀도 측면에서 유리한 점이 커 많은 소비자와 산업ㆍ군사 응용 분야에서 선택되는 전원 공급 장치가 됐다.
그렇기에 리튬이온 배터리를 본질적으로 더 안전하게 사용하기 위해 화학 물질을 개발하고 보다 효과적인 열 관리 시스템과 보호 장치를 개발하는 데 상당한 연구와 노력이 투자됐다(Balakrishnan et al., 2006; Hassoun et al., 2009).
이 논문의 목적은 작동 중 리튬이온 배터리의 안전을 손상시킬 수 있는 부반응과 열 거동에 초점을 맞춰 기술의 안전 특성을 검토하는 데 있다.
특히 SEI(Solid Electrolyte Interface)가 온도 변화에 어떤 영향을 받고 어떻게 열폭주에 영향을 미치는지 잘 정리됐다. 리튬이온 셀이 고온에서 어떤 취약성이 있는지 확인도 가능하다.
리튬이온 배터리와 관련된 위험
(Hazards associated with lithium-ion cell)
초기 리튬 금속을 이용한 셀은 양극에 리튬 금속을 사용해 개발된다. 하지만 리튬 금속의 불안정한 특성 때문에 일차 리튬 배터리의 안전과 관련된 문제가 다음과 같이 발생한다.
1. 일반적으로 리튬 금속이 물과 접촉하면 발화될 수 있다. 이때 반응으로 인화성이 높은 수소 가스가 발생한다. 이런 수분 발생은 부적절하게 건조된 셀 구성 요소에서 발생하거나 셀의 기계적 손상에 의해 유입될 수 있다(Lim et al., 2007).
2. 리튬 금속을 이용한 배터리를 재충전하면 리튬 덴드라이트가 형성된다. 이는 안전상의 문제로 오랫동안 이슈가 됐다(Park et al., 2008).
3. 셀의 온도 상승과 자체 발열 때문에 내ㆍ외부 안전장치로 관리하지 않으면 열폭주가 발생할 수 있다. 높은 에너지의 일차 리튬 배터리는 자체 발열로 온도가 상승하고 온도가 높아질수록 상승 속도 또한 빨라지는 것으로 보고됐다(Mores and Ottaway, 1998).
 |
따라서 이런 문제 해결 방법으로 리튬 금속을 코발트(Co), 망간(Mn)과 같은 금속, 이온 상태로 결합한 산화물계 양극재를 개발해 제안한다.
이 양극재를 적용한 리튬이온 셀은 정상적인 상황에서 충전 시 리튬 금속이 재증착되지 않아 오랫동안 리튬 금속을 양극으로 사용하는 배터리에 대한 안전한 대안으로 여겨졌다(Balakrishnan et al., 2006).
 |
양극과 음극에 대한 수많은 재료가 수년에 걸쳐 제안된다. 기존 리튬이온 배터리의 상당 부분은 LiCoO2 같은 리튬을 포함하는 금속 산화물인 양극과 함께 탄소 기반 음극을 사용하게 된다.
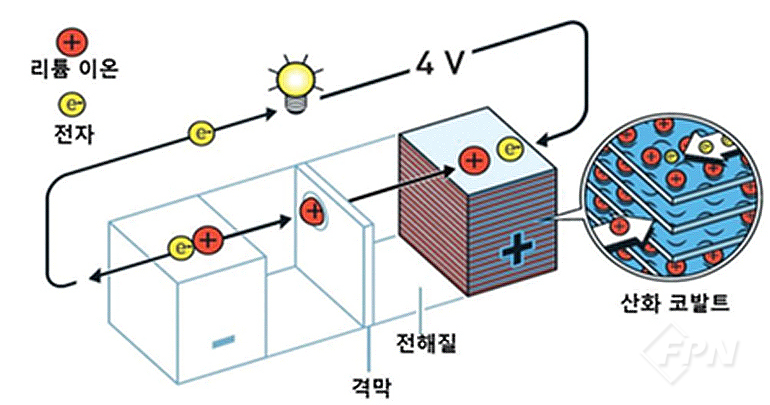 |
전해질은 에틸메틸 카보네이트(EMC) 또는 에틸렌 카보네이트(EC) 등과 같은 카보네이트계 유기 용매에 용해될 수 있는 리튬염(예 LiPF6, LiBF4 등)으로 구성된다.
전해액(전해질 용액), 양극ㆍ음극을 위한 새로운 재료(Fergus, 2010; Gulbinska et al., 2011)는 용량, 에너지 밀도, 수명과 같은 전기화학적 성능 매개변수뿐만 아니라 안전한 성능을 개선하기 위해 지속적으로 개발되고 있다.
하지만 각각의 재료 등이 다양한 환경과 조건에 따라 원치 않은 부반응 등이 발생하는데 리튬이온 셀과 관련된 위험은 다음과 같은 부반응에서 비롯될 수 있다.
1. 금속 리튬 배터리를 과충전하면 금속 리튬의 녹는점이 낮아 용융 리튬이 형성될 수 있다(180℃). 그러나 이는 금속 리튬이 리튬화 탄소 물질로 대체되기 때문에 리튬이온 배터리에서 발생할 가능성이 작다.
2. 유기 용액과 전극 표면 사이의 반응은 배터리 온도가 상승할 때, 특히 SEI가 파괴될 때 발생한다. SEI는 전해질 용액과 전극 사이의 접촉면으로 배터리가 처음 충전될 때 생성되는 불용성 생성물로 구성된다(Doh et al., 2009). 이 계면은 전지 온도가 70~100℃ 이상으로 올라가면 불안정해지고 발열로 인해 분해된다.
3. 발열에 따른 열 관리는 리튬이온 셀의 안전한 작동에 매우 중요하다. Viswanathan et al., 2010에서 검토한 바와 같이 배터리 관리 시스템에서는 가역ㆍ비가역적인 발열(되돌릴 수 없는 온도 상승)을 모두 고려해야 한다.
내부 저항은 비가역적인 열에 대한 책임이 있는 반면에 가역적인 열은 양극에서 발생하는 환원 반응, 음극에서 발생하는 열과 관련이 있다.
리튬이온 배터리의 열폭주
(Thermal runaway of lithium-ion batteries)
해당 논문에서 리튬이온 배터리의 열폭주는 3단계 과정으로 설명된다(Abraham et al., 2006; Selman et al., 2001).
 |
1. 열폭주 첫 번째 단계에서는 양극에서 산화 반응(Anodic reactions)에 의해 약 90℃에서 반응이 시작되고 발열 속도가 꾸준히 증가한다. 이 온도 구간에서 온도가 낮아지지 않으면 비가역적인 온도 상승이 발생하게 된다. 온도가 120℃ 이상으로 올라가면 SEI 층이 분해되고 음극에서 전해질의 감소가 이어진다.
2. 열폭주 메커니즘의 두 번째 단계에서는 활물질의 조성에 따라 온도가 약 140~160℃ 이상 높아지고 양극에서 반응이 시작된다.
3. 마지막 세 번째 단계는 온도가 분당 100℃까지 상승하는 고속 발열 단계가 특징이며 180℃ 이상의 온도에서 발생한다. 이때 양극은 빠르게 분해되고 구조 내 산소가 탈리된다. 또 열폭주로 이어져 눈 깜짝할 사이에 온도가 수백℃ 이상 올라간다.
리튬이온 셀의 열폭주와 열 효과는 충전 상태에 민감하다. 동일한 셀 유형의 경우 셀의 이력과 적용된 부하에 따라 달라진다. Zhang et al.(1998)에 의해 수행된 테스트에서는 양극 물질에 따라 열 안정성이 달라졌다. LiCoO2 또는 LiNiO2를 포함하는 셀은 LiMn2O4보다 더 열악한 성능을 보였다.
또 전해질 조성에 따라 열 안정성이 달라지며 영향을 미치는 게 보고됐다(에틸렌 카보네이트/디메틸 카보네이트가 에틸렌 카보네이트/디메틸 에테르보다 안정적임).
리튬이온 배터리의 전해액 분해와 발생 가스 종류의 진화
(Electrolyte decomposition and evolution of gas species from lithium-ion batteries)
리튬이온 셀의 열 효과는 가스를 생성시켜 셀 내부 압력을 높일 수 있으며 이를 통해 배터리 파열을 유발할 수 있다. Ohsaki et al.(2005)에 따르면 리튬이온 배터리 과충전 시 발생한 가스의 구성물인 CO2와 CO는 양극에서 발생하는 것으로 밝혀졌다. 소량의 메탄(<10%)도 생성된다.
이는 음극(흑연)에서의 CO2 반응 때문이 아니라 양극에서 전해질의 산화에 의해 생성됨을 확인시켜 줬다. 인화성 가스도 발생할 수 있다. H2는 소량의 CH4, C2H4, C2H6와 함께 음극(약 50%)에서 발생한 가스의 주성분이다.
전해액의 리튬염인 LiPF6는 분해되면서 LiF와 PF5를 형성하며 PF5는 용매 분해의 촉매 역할을 하게 된다(Abraham et al., 2006). 전해질 분해 메커니즘의 증거는 Onuki et al.(2008)에서 확인할 수 있다.
리튬이온 셀의 LiNixCoyAl1‑x‑yO2(LNCAO) 전극은 기존 LiCoO2 전극보다 더 많은 양의 CO2를 생성한다. 에틸렌 카보네이트(EC)가 CO2의 주요 공급원이지만 CO는 용매나 비용매 성분으로 형성되는 것으로 보인다.
C2H6의 형성은 에틸렌 카보네이트(EC)와 관련이 있지만 C2H4는 디에틸 카보네이트(DEC)에 의해 생성됐다. Konget al.(2005)은 LiCoO2와 LiMn2O4, LiFePO4 전극이 있는 리튬이온 배터리에서 유사한 가스 발생 패턴을 보고했다.
그러나 LiMn2O4와 LiFePO4 시스템은 전압이 증가함에 따라 LiCoO2보다 더 많은 양의 C2H2를 생성하는 것으로 밝혀졌다. 이를 통해 전해액과 전극의 종류에 따라 반응에 의한 생성물 등이 달라지는 걸 알 수 있다.
Results
우린 이 논문을 통해 배터리 SEI 분해 거동과 그에 따른 열폭주 등에 대해 알 수 있었다. 특히 리튬이온 배터리의 구성 재료인 양극, 음극, 전해액 등에 따라 생성되는 물질과 위험성이 다르다는 점에 대한 이해를 얻을 수 있다고 생각한다.
다소 내용이 생소하고 어려울 수 있지만 열폭주의 결과만이 아닌 현상의 과정과 의미를 이해한다면 올바른 방향성 정립에 도움이 될 수 있지 않을까. 리튬이온 배터리 화재에 대한 더 나은 예방ㆍ대응 방법이 나오길 기원한다.
표기ㆍ용어 설명
ㆍ일차 전지(primary battery): 재충전이 안 되고 한 번만 사용할 수 있는 전지
ㆍ이차 전지(secondary battery): 방전된 후 충전해서 다시 쓸 수 있는 전지
ㆍ‘배터리(battery)’ 어원: ‘배터리’는 원래 군대 용어로 군대의 대포, 로켓포 등을 일렬로 모아두는 걸 배터리라고 한다. 전지에 전쟁과 관련된 군대 용어 ‘battery’라는 말을 사용하게 된 건 미국의 벤자민 프랭클린(Benjamin Franklin)이 1748년 여러 전지의 연결을 무기가 함께 작동하는 포열(battery of cannon)과 비슷하다는 비유로 도입한 게 시작이다.
ㆍ셀(cell): 전지의 기본 단위(한 개의 셀)
ㆍ배터리(battery): 셀을 한 개 또는 여러 개 붙여서 같이 작동하게 할 때 배터리라고 한다.
ㆍ양극(anode)과 음극(cathode): 양극은 산화 전극(oxi-dation electrode), 음극은 환원 전극(reduction electrode)으로 이해하면 된다.
ㆍSEI(Solid Electrolyte InterfaceI): SEI는 배터리 제조 후 처음으로 충전할 때 전극 표면에 생기는 얇은 막(Thinfilm)
참고 자료
1. Diego Lisbona∗, Timothy Snee., 2006. A review of hazards associated with primary lithium and lithium-ion batteries. Process Safety and Environmental Protection 89 (2011) 434–442
2. Abraham, D.P., Roth, E.P., Kostecki, R., McCarthy, K., MacLaren, S.,Doughty, D.H., 2006. Diagnostic examination of thermally abused high-power lithium-ion cells. J. Power Sources 161, 648–657.
3. Selman, J.R., Al Hallaj, S.A., Uchida, I., Hirano, Y., 2001.Cooperative research on safety fundamentals of lithium batteries. J. Power Sources 97–98, 726–732.
경기 구리소방서_ 강경석 : youeks@naver.com
<본 내용은 소방 조직의 소통과 발전을 위해 베테랑 소방관 등 분야 전문가들이 함께 2019년 5월 창간한 신개념 소방전문 월간 매거진 ‘119플러스’ 2023년 7월 호에서도 만나볼 수 있습니다.>
'화재감식평가' 카테고리의 다른 글
| ‘부실 투성’ 부산 씨클라우드호텔 화재… “지하주차장 제도 고쳐야” (0) | 2023.07.28 |
|---|---|
| [화재조사관 이야기] “숙면하고 있을 때 슬며시 재난이 찾아와 인명피해가 발생했다” (0) | 2023.07.20 |
| 안전은 지킬 때 행복하고 간과하면 재난이 찾아든다 (0) | 2023.06.20 |
| 소방이 주도하는 화재조사 체계가 필요합니다 (0) | 2023.06.20 |
| ‘위험천만 배터리 화재’, 효과적 대응 위한 기술은 없을까 (0) | 2023.06.20 |